Il 1 gennaio 1803, il chimico John Dalton sviluppò una teoria molto persuasiva che portò a una realizzazione sorprendente sull’ atomo: forse tutta la materia era fatta di minuscoli pezzi.
Oggi sappiamo tutti che la materia è costituita da particelle invisibili ad occhio nudo chiamate atomi e che ogni oggetto vibile è composto da un numero variabile ma alto di queste particelle invisibili. In effetti, servono di quadrilioni di atomi solo per costruire una piccola particella di materia abbastanza grande da poter essere risolta dalle nostre capacità visive biologiche.
Gli atomi sono così piccoli che abbiamo ancora difficoltà a vederli nonostante la nostra tecnologia avanzata. Ma qualche progresso è stato fatto in questo campo: oggi è possibile addirittura manipolarli uno alla volta.
Ci è possibile osservarli grazie ai microscopi elettronici avanzati ed appaiono come minuscoli granelli rotondi. Questa tuttavia è ancora solo una rappresentazione molto approssimativa dell’aspetto dell’atomo, perché sappiamo che queste particelle sono costituite da diverse particelle subatomiche strettamente legate da forze fondamentali.
Gli atomi potrebbero essere scomposti
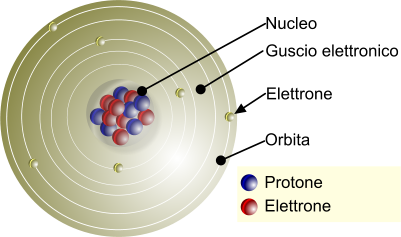
Nonostante il nome atomo derivi dal termine greco “atomos”, che significa “indivisibile“, i fisici sanno che gli atomi non sono palline solide. È meglio pensarli come minuscoli sistemi “planetari”.
Sono tipicamente costituiti da tre parti principali: protoni, neutroni ed elettroni. Pensa ai protoni e ai neutroni come se insieme formassero un “sole”, o nucleo, al centro del sistema. Gli elettroni orbitano attorno a questo nucleo, come i pianeti.
Qual è il modo migliore per immaginare un atomo, sulla base di ciò che gli scienziati sanno su di loro?
Il seguente video spiega come apparirebbero gli atomi se fosse possibile ingrandirli, o meglio, ingrandire le loro immagini in stop-motion, fino a rendere la loro struttura interna chiaramente visibile:
Il percorso dell’atomo:
La forma di un atomo – Democrito 460 a.C.
Prima di Aristotele, fu Democrito a sviluppare una teoria atomica, affermando che gli atomi erano “indistruttibili” e che esiste un numero infinito di atomi (di tutte le forme e dimensioni).
Democrito mostrò le prime idee di forme e la connessione degli atomi. Lavorò con Leucippo ed Epicuro e pensò che la forza/”solidità” di un atomo dipendesse anche dalla sua forma. Gli atomi d’acqua erano lisci, gli atomi di sale erano ruvidi, ecc. “per convenzione amari, per convenzione dolci, ma in realtà atomi e vuoti”.
Aristotele, 340 a.C., i 4 elementi
Aristotele credeva che quattro elementi costituissero tutti i materiali, non gli atomi (ci sono anche fonti che ne accreditano cinque). Questi “elementi” includevano: la terra, che era secca e fresca; fuoco, che è caldo e secco; aria, che è calda e umida; e acqua, che è fresca e bagnata.
Il quinto elemento era l’etere, che componeva tutte le stelle e i pianeti. Oltre a Platone, Aristotele non fu influenzato dagli scienziati.
“La prima svolta” – Antoine Lavoisier – 1 gennaio 1774
Antoine Lavoisier è stato il primo a rivoluzionare lo studio delle reazioni chimiche. Nel 1774 dimostrò che la massa totale della materia è la stessa all’inizio e alla fine di una reazione chimica. Dimostrò la legge di conservazione della materia che affermava che la materia/gli atomi non vengono né distrutti né creati in una reazione chimica.
La teoria atomica – John Dalton – 1 gennaio 1802
Nel 1802, John Dalton sviluppò la teoria atomica della materia. Affermò che ogni tipo di materia era costituita da un solo tipo di atomo. Dalton credeva anche che gli atomi fossero le particelle più piccole a costituire la materia, che non potessero essere distrutti, smontati o creati. Dalton affermò che gli atomi avevano tutti un peso e un aspetto diversi.
Il numero atomico – Henry Moseley – 1 gennaio 1913
Nel 1912, dopo aver sperimentato con le particelle beta, Henry Moseley scoprì che dal radio si potevano trovare alti potenziali, creando così la prima batteria atomica. Nel 1913, Moseley scoprì una relazione matematica tra le lunghezze d’onda dei raggi X e il numero atomico dei metalli usati come bersagli, nota come legge di Moseley.
Il neutrone – James Chadwick – 1 gennaio 1932
James Chadwick effettuò la prima trasformazione nucleare artificiale nel 1919, bombardando un atomo con particelle alfa, portandolo così a compiere studi multipli sui nuclei. Nel 1932, Chadwick dimostrò l’esistenza dei neutroni.
Dopo aver bombardato il berillio con particelle alfa, vide quella che era la radiazione gamma riflessa. Ma durante la ricerca, Chadwick scoprì che queste particelle erano neutre, e le chiamò neutroni. Nel 1941 scrisse il rapporto MAUD, ispirando gli Stati Uniti a esaminare la fattibilità della bomba atomica.
Teoria quantistica – Erwin Rudolf Josef Alexander Schrödinger – 1 gennaio 1935
Formatosi sulle opere di Niels Bohr, Albert Einstein e così via, Schrödinger si interessò molto alla meccanica quantistica. Schrödinger portò il modello di Bohr un passo avanti.
Creò un modello di meccanica quantistica che non mostra un percorso definito per l’atomo ma le possibilità di dove potrebbe essere. L’immagine mostra il nucleo e la nuvola di elettroni. Quando la nuvola è densa, allora c’è la possibilità di più elettroni, introducendo livelli di sottoenergia.